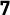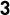|
第7回医療マーケティング研究 報告会レポート 「医薬品マーケティング(Pharmaceutical Marketing)を考える:医療環境の変化を先取りする」 |
第7回 医療マーケティング研究報告会
テーマ:「医薬品マーケティング(Pharmaceutical Marketing)を考える:医療環境の変化を先取りする」
第7回医療マーケティング研究報告会は、「医薬品マーケティング(Pharmaceutical Marketing)を考える:医療環境の変化を先取りする」をテーマに行われました。
内 容: *敬称略
- 解題 川崎医科大学総合外科学 教授 猶本良夫
- 我が国におけるこれからの医療行政:国家健康戦略を担うPMDAとAMED
川崎医科大学総合外科学 教授 猶本 良夫・准教授 山辻 知樹 - 新しい医薬品マーケティングに求められること: 生活者発想による医薬品マーケティング
博報堂メディカル コンサルティンググループマネージャー 石附 洋徳 - 製薬会社のマーケティングにおける課題整理
日本ベーリンガーインゲルハイム ブランド企画グループマネージャー 利重 寛
日 程:2015年2月8日(日) 9:30-13:00
場 所:岡山国際交流センター 5階 第1会議室
【猶本良夫先生による解題】
医薬品マーケティングは重要なテーマであり、学会として取り上げるニーズがあると認識しておりますが、今はまだ十分な研究蓄積もありません。そこで本学会としても、今後、テーマの一つとしてぜひ取り組んでいきたいと思います。今日はそのトライアルとしての企画で、3名の先生方にご登壇頂きます。活発な議論の場となることを期待しております。

解題:猶本先生
【山辻知樹先生による第1報告の内容】
本日のテーマは「我が国におけるこれからの医療行政:国家健康戦略を担うPMDAとAMED」です。①日本の医薬品産業の概況、②ドラッグラグ、③審査・対面助言の論点、そして④PMDAとAMED(エイメッド)という流れでお話しします。
PMDAはPhamaceuticals and Medical Devices Agency、独立行政法人医薬品医療機器総合機構です。平成25(2013)年6月14日に閣議決定された日本再興戦略で、国民の健康長寿延伸や世界最先端医療の実現が強調されました。医薬品では、PMDAと国立医薬品食品衛生研究所・大学等の人材交流を促進し、開発初期から明確なロードマップ相談が実施できるよう、薬事戦略相談を拡充することが示されています。このPMDAが今後のアベノミクスの健康戦略における中心的な役割を担います。
日本の医薬品市場は2011年現在、約1,000社が参入し、アメリカに次いで世界第2位の規模となっています。医薬品市場における課題の1つがドラッグラグ、すなわち欧米で使用が認められている医薬品が国内では承認されていないために使用できない状況にあることです。2011年現在、ドラッグラグは平均3.5年で、審査ラグは短くなっていますが、開発ラグが依然として長い状況です。
ドラッグラグを解消するには、①国際共同治験を促進し、治験の開始時期を早めること、②治験・臨床研究ネットワーク体制を推進すること、③PMDAの審査員の増員により治験相談の内容を充実させることが必要です。

第1報告:山辻先生
アメリカのFDAは、審査は304日と短く、職員数は5,400人と日本の約10倍です。日本は治験環境が未整備で、治験が医師主導で行われるようになったのは2004年以降のことです。一方、臨床試験は大学の倫理委員会で許可されれば実施可能であるため敷居が低く、そのため最初からGCP基準(Good Clinical Practice)を満たす治験が行われにくい傾向にありました。一方、欧米では、治験も臨床試験もGCP基準で行われるため、医師が行う通常の臨床試験でも新薬として承認される可能性が高いのです。
臨床試験には第Ⅰ相(フェーズI)、第Ⅱ相(フェーズⅡ)、第Ⅲ相(フェーズⅢ)があり、それぞれ安全性の確認、有効性の確認、従来の標準治療との直接比較による総合評価を目的としています。たとえば、フェーズⅡで承認が可能であれば、迅速に発売できます。
アメリカで1992年に導入されたFDAの迅速承認制度(Accelerated Approval)は画期的な制度です。承認後の比較試験を義務付けたうえで、がんやエイズ等の致死的疾患をフェーズⅡで認可しています。一方、日本では、がんの場合、延命効果を中心に評価するフェーズⅢの成績の提出が必須であり、フェーズⅡでの承認は難しいのが現状です。ただし、対象患者が著しく限定される場合には、サンプル数が少なくても承認されるケースは存在します。
最後に、日本版NIH改めAMED(Japan Agency for Medical Research and Development、日本医療研究開発機構)について説明します。AMEDは医療分野の研究開発の司令塔で、基礎・応用研究、非臨床試験・動物実験から臨床研究・治験、審査・薬事承認、国際展開までを一貫して支援する組織です。内閣府・文科省・厚労省・経産省他で管轄が分かれていた研究管理を統一し、研究費などのワンストップサービス化が図られました。
しかし、日本版NIHとアメリカのNIHは全く違います。アメリカのNIHは約3兆円の巨大予算を有するのに対し、日本のAMEDの予算規模は約1,200億円です。この日本版NIHには多くの学会が反対していましたが、アベノミクスの動きは早く、オールジャパンで医薬品創出を加速化させる動きは確実に始まっています。
【石附洋徳氏による第2報告】
私は2011年に博報堂メディカル創設メンバーとして参画し、戦略構築からブランディングまでを一貫して行う業務に携わっています。今日は「新しい医薬品マーケティングに求められること: 生活者発想による医薬品マーケティング」というテーマで報告します。
マーケティング3.0の時代は、社会価値・相互幸福を求める時代です。医薬品もそういう時代に来ています。私自身は、マーケティングの役目は「みんなが幸せになれる状態を導き出すこと」と考えています。
これまでの医薬品マーケティングの歴史を振り返りましょう。まず医薬品マーケティング1.0の時代は、良薬の登場で不治の病が治療できるようになり、医師の感覚と患者の声が重視され、製薬会社と医師の関係の中で医薬品が売れた時代です。
次に、医薬品マーケティング2.0の時代はパワーマーケティングの時代で、EBMすなわちエビデンス・ベース・マーケティングが中心です。選択と集中による効率化、その成果測定としての重要業績評価指標(Key Performance Indicators: KPI)が重視され始めました。
高血圧治療剤ディオバンがこの時代の代表例です。ディオバンはマーケティングとしては大成功でした。赤とトロフィーのシンボリックなブランドイメージを何度も何度も刷り込んでメッセージを浸透させ、医師のマインドシェアを獲得していったパワーマーケティングの典型的な事例といえるでしょう。
この頃の医薬品のブランドマネジャーは、毎月トラッキング調査を見てマインドシェアをチェックし、医師のランキングを行ってセールス・プロモーション戦略を立案し、KPIでMRの活動を評価するといった流れでマーケティング・マネジメントを行っていました。
しかし、医師主導ではなく製薬会社が入ることで、臨床試験が恣意的になる恐れがある中で、透明性の厳格化や批判的な国民感情の高まりも生じてきました。製薬会社のマーケティングも、医薬品の機能性・有効性だけでなく、継続率やQOLを含んだ顧客(患者)にとっての価値を考えて行う時代になってきています。コンプライアンスからアドヒアランス(患者が治療方針の決定に参加し、その方針に従って治療を受けること)へと移行する中で、生活者として患者をとらえてマーケティングを行うことが必要です。
患者だけでなく、医師も生活者です。医師に対しては、薬剤の範疇を超えた情報提供も求められるでしょう。すべてに共通するキーワードは生活者発想です。薬剤を入り口とした医療全体の価値提供を考えることが、これからの製薬会社に求められるマーケティングだと思っています。

第2報告:石附氏
【利重寛氏による第3報告】
今日は「製薬会社のマーケティングにおける課題整理」ということで、ブロックバスターモデルの転換期における製薬会社のマーケティングの課題について報告します。
私はP&GでおむつのR&Dを担当し、技術開発や消費者リサーチ、コンセプト開発等に携わりました。2002年に神戸大MBAに進学し、石井ゼミに所属しました。今は外資系の製薬会社でCOPD(肺気腫・慢性気管支炎)の治療薬を担当しています。
COPDの認知度は高くないのですが、日本では死因の9位、男性では7位で、今後増えていきます。自覚症状が出た時には遅く、在宅酸素になってしまうことがあるため、早くから治療介入が必要な病気です。健康日本21で、がん・循環器疾患・糖尿病に並ぶ主要取組疾患になりましたが、平成23年度の認知度は25%で、平成34年度に80%に引き上げるという目標が立てられています。疾患自体を啓蒙すれば、医療経済的にも医療費削減につながるという試算結果も出ています。
製薬会社のマーケティング部門の仕事には、販売戦略の企画・立案・実行、市場動向やニーズの分析、MRと協力して行う自社製品のプロモーション活動、医師との情報交換や海外関連学会における情報収集等があります。


写真左から、第3報告:利重氏、研究会全景
製薬会社のマーケティングに関して、学会では最近どんなトピックが注目されているのでしょうか。2014年のJournal of Medical Marketingのデータベースを検索したところ、19件の論文がヒットしました。キーワードは、製品ライフサイクルマネジメント、ジェネリック、薬価・コスト、プロモーションの影響、メーカーが関与する教育プログラム、DTCマーケティング、技術力、グローバル、適用外使用、薬局、ヘルスケアシステム等です。
次に、当社の社員3名が考える課題についてインタビューしました。社員Aは、4PのうちProduct、Place、Priceが固定され、Promotionしか打つ手がない中で、限られたパイの中での奪い合いだと感じています。社員Bは、売上至上主義のブロックバスターモデルとEBMが本当に患者のためになっているか、売れればそれでいいのかと疑問を呈しました。社員Cは、医薬品は製品そのもののポテンシャルの影響が大きく、マーケティングというよりは、プロダクトと患者の単なるマッチングになっていると言っていました。
一世風靡したブロックバスターモデルも転換期を迎えています。ブロックバスターは、従来の治療体系を覆す薬効を持ち、圧倒的な売上高と利益を生み出す新薬で、1剤で年1,000億円以上の規模になります。しかし最近では、最大公約数でメッセージを統一しても機能しなくなってきました。一方、アンメット・メディカル・ニーズ(Unmet medical needs)を目指して開発しても、同じ時期に同じ領域の薬剤がものすごくたくさん出てきます。後発で発売しても、採用されることすら難しいのが現状です。
平成25年度現在、日本の医療費は39兆円で、後発医薬品(ジェネリック)は数量ベースで約2割に留まり、厚生労働省は平成26年の薬価改定でジェネリックの定義を変えて、さらに推進する方向にあります。
去年、製薬会社が驚愕した話があります。2014年6月にディオバンの特許が切れてジェネリックが出てきた時の売上の落ち方がすごかったのです。日本ではアメリカよりもジェネリックのインパクトがないと思われていたので、業界に衝撃が走りました。
これからどんどんブロックバスターの特許切れが起きてきます。2012年には、医薬品市場におけるブロックバスターが占める割合の品目数と売上が初めて減少しました。一方、中外製薬(ロシュ)は希少疾患やオンコロジー領域に力を入れており、年間1,000億円の薬剤はありません。アバスチンは非常に売れていますが、200~300億円の医薬品を積み上げて、将来の特許切れリスクに対応しています。
今後は、医療における倫理の問題もますます重要になります。宣伝や情報提供の規制を始め、コンプライアンスは日々厳格化する傾向にあります。たとえば、疾患啓発等のタイアップ広告では、自社製品の宣伝ととられる表現は避けなければなりません。
薬価改定の度に、薬剤費は減少し続けてきました。ジェネリックの推進で薬剤費はさらに圧縮されます。製薬会社には、アンメット・ニーズを探り、大きく稼ぐブロックバスターモデルからコツコツとヒットを重ねるビジネスモデルへと移行することが求められています。
【報告会を終えて】
医薬品マーケティングは、R&D、臨床試験・治験からセールス・プロモーションまで幅広く、論点も多様です。今回の研究報告会では、医師、製薬企業、広告代理店、病院のメディカルスタッフ、医療コンサルティング企業、学者といった、さまざまなバックグラウンドの出席者がそれぞれの観点から意見を交換し、マーケティング視点で議論を深めることができました。終了後の感想でも、業界関係者が腹を割って話せる貴重な場なので、ぜひこうした機会を継続してほしいという要望を頂きました。
質疑応答で提示された今後の論点としては、医師主導の治験に適した医薬品のポジショニング、生活者視点に立った新たな価値提案、地域連携・チーム医療とB2B購買意思決定プロセスの変化、DTC(Direct to Consumers)と効果測定等があります。いずれも喫緊かつ重要な研究テーマであり、本研究会でもぜひ議論を重ねていきたいと考えています。
(文責:医療マーケティング研究会プロジェクト リーダー 川上 智子)